ANSM - Agence nationale de sécurité du médicament et des produits de santé
Résumé, définition
L’Agence nationale de sécurité du médicament et des produits de santé (ANSM) a été créée par la loi du 29 décembre 2011 relative au renforcement de la sécurité sanitaire des médicaments et des produits de santé. Elle assure la sécurité des médicaments et des autres produits de santé tout au long de leur cycle de vie. Agence d’évaluation, d’expertise et de décisions dans le domaine de la régulation sanitaire des produits de santé, l’ANSM agit au nom de l’État pour garantir la sécurité du patient.
L’ANSM est l’autorité compétente pour ce qui concerne les dispositifs médicaux (DM) et les dispositifs médicaux de diagnostic in vitro (DMDIV). Elle assure notamment l’évaluation des dossiers d’autorisation des recherches biomédicales, les activités de matério- et réactovigilance, et de surveillance du marché (documentaire, laboratoire, inspections).
/!\L’ANSM n’intervient pas dans le processus de marquage CE des DM et DMDIV. Ce marquage CE reste sous la responsabilité des fabricants avec, selon la classe de risque des dispositifs, l’intervention d’un organisme notifié de son choix. Les organismes notifiés sont désignés et surveillés par les autorités responsables nationales. L’ANSM est chargée de désigner et surveilles les organismes notifiés en France.
Le parcours
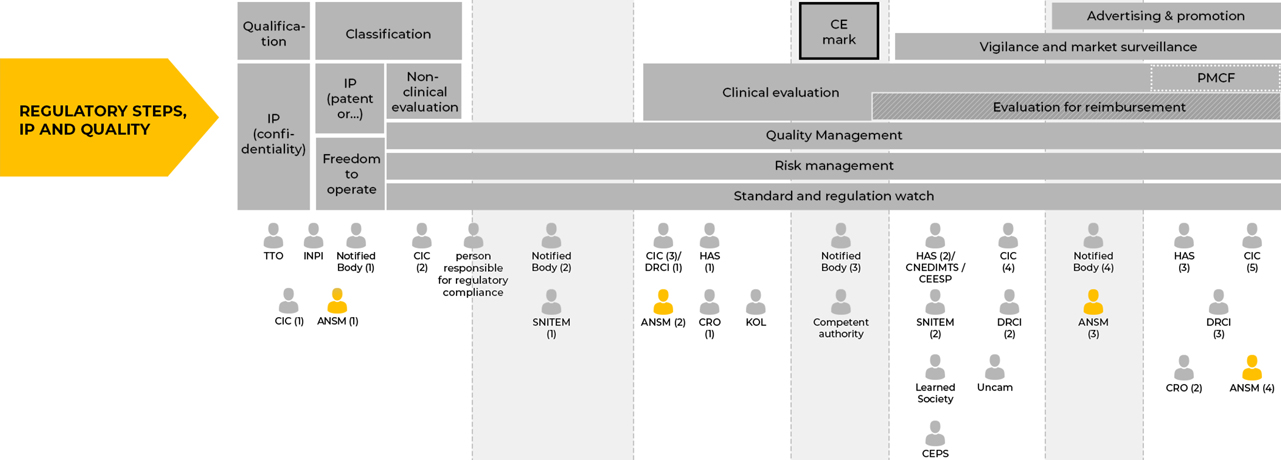
(1) Qualification et classification des dispositifs médicaux
La qualification et la classification du DM selon les règles de la réglementation européenne en vigueur sont sous la responsabilité du fabricant. L’ANSM peut être saisie sur demande en cas de désaccord entre le fabricant et l’organisme notifié.
(2) Essais cliniques
Les recherches impliquant la personne humaine portant sur les dispositifs médicaux ou dispositifs médicaux de diagnostic in vitro peuvent être des recherches non interventionnelles, des recherches interventionnelles ou des recherches interventionnelles à risques et contraintes minimes (article L. 1121-1 du code de la santé publique, décret n° 2016-1537 du 16 novembre 2016). Ces recherches sont soumises à un avis d’un comité de protection des personnes et selon le cas à une autorisation délivrée par l’ANSM.
Les recherches interventionnelles font l’objet d’une demande d’autorisation à l’ANSM notamment :
- lorsqu’ils portent sur des DM non pourvus du marquage CE,
- sur des dispositifs médicaux déjà pourvus du marquage CE et utilisés dans une nouvelle indication (différente de celle du marquage CE),
- lorsque ces essais cliniques de DM nécessitent pour les besoins de l’essai la pratique d’explorations à risque non négligeable.
(3) Mise sur le marché
Au moment de la mise sur le marché, le fabricant / le mandataire voire le distributeur peut avoir à suivre une procédure de déclaration de mise sur le marché ou de communication de mise en service selon la classe du dispositif.
La publicité pour les dispositifs médicaux s’entend par toute forme d’information (y compris le démarchage), de prospection ou d’incitation visant à promouvoir la prescription, la délivrance, la vente ou l’utilisation de ces dispositifs. La publicité auprès du grand public et des professionnels de santé est réglementée et peut faire l’objet d’une autorisation préalable de l’ANSM.
(4) Après la mise sur le marché
Les fabricants de dispositifs médicaux ont une obligation réglementaire de mettre en place une surveillance du dispositif après commercialisation et d’assurer les activités de matériovigilance. La matériovigilance s’exerce sur les dispositifs médicaux après leur mise sur le marché, qu’ils soient marqués CE ou non, en dehors de ceux faisant l’objet d’investigations cliniques. La matériovigilance a pour objectif d’éviter que ne se (re)produisent des incidents et risques d’incidents graves (définis à l’article L.5212-2 du Code de la santé publique) mettant en cause des dispositifs médicaux, en prenant les mesures préventives et /ou correctives appropriées. Les incidents de matériovigilance sont évalués par l’ANSM.
L’ANSM contrôle également les conditions de mise sur le marché des dispositifs médicaux et s’assure de la conformité à la réglementation des dispositifs déclarés par le fabricant. Elle organise à son initiative ou sur saisine du ministère chargé de la santé la mise en œuvre d’actions permanentes, d’enquêtes ponctuelles et de programmes thématiques décidés annuellement. Ces opérations de contrôle de marché et d’évaluation n’ont pas pour objectif de déterminer les performances des dispositifs, ce qui est de la responsabilité de l’industriel, mais de mettre en évidence une éventuelle non-conformité par rapport aux performances annoncées et/ou par rapport à l’état de l’art : http://ansm.sante.fr/Activites/Surveillance-du-marche-des-dispositifs-medicaux-et-dispositifs-medicaux-de-diagnostic-in-vitro-DM-DMDIV/Surveillance-du-marche/(offset)/0
L’ANSM mène également des campagnes d’inspection des différents opérateurs du dispositif médical.
L’inspection permet d’établir un degré de confiance dans la qualité des pratiques des opérateurs qui restent en premier lieu responsables de leurs pratiques, de la qualité et de la sécurité des produits de santé et de la sécurité des patients inclus dans des essais.
L’inspection peut être à l’origine du déclenchement de suites administratives, pénales ou ordinales.
http://ansm.sante.fr/Activites/Processus-d-inspection/Processus-et-rapports-d-inspection/(offset)/0
Enfin, l’ANSM contrôle les dispositifs médicaux au sein de ses laboratoires. Le contrôle des produits de santé par les laboratoires de l’ANSM est une activité essentielle complémentaire de l’évaluation et de l’inspection. Il apporte une expertise technique et scientifique indépendante sur la qualité des produits de santé et leur sécurité d’emploi.
Ressources Internet
Le site de l’ANSM est très complet et met à disposition de nombreux documents réglementaires et guides pour les opérateurs. : http://ansm.sante.fr/
Règlement européen2017/745 (signé le 5 avril 2017) : http://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1516896388241&uri=CELEX:32017R0745
Vademecum réglementaire d’Aviesan : https://aviesan.fr/aviesan/accueil/menu-header/vademecum-reglementaire

