Notified body
Résumé, définition
Si votre DM a vocation à être commercialisé dans le marché européen, il doit se voir apposer le « marquage de conformité CE » ou « marquage CE ». La procédure d’évaluation de la conformité peut nécessiter l’intervention d’un organisme notifié.
Les organismes notifiés sont responsables de l’évaluation de la sécurité et de la performance de certains dispositifs, de la délivrance du certificat d’évaluation et de la vérification du système qualité du fabricant. Il sont désignés par les « autorités compétentes ».La liste des organismes notifiés est consultable sur le site de la commission européenne.
Le LNE/G-MED est le seul organisme notifié français au titre des Directives européennes applicables aux DM.
/!\La réglementation européenne relative aux DM a récemment fait l’objet d’un processus de révision complet. Trois directives européennes concernaient les DM : 93/42/CEE, 98/79/CE et 90/385/CEE. Elles sont valables jusqu’en 2020. Cette fiche se réfère aux exigences du nouveau règlement (règlement (UE) 2017/745).
/!\C’est le fabricant qui choisit l’organisme notifié à qui revient la mission de conduire l’évaluation de la conformité aux exigences générales en matière de sécurité et de performances du DM. Ce choix, stratégique, est libre à condition que le DM à évaluer entre dans le champ de compétences de l’organisme.
Le parcours
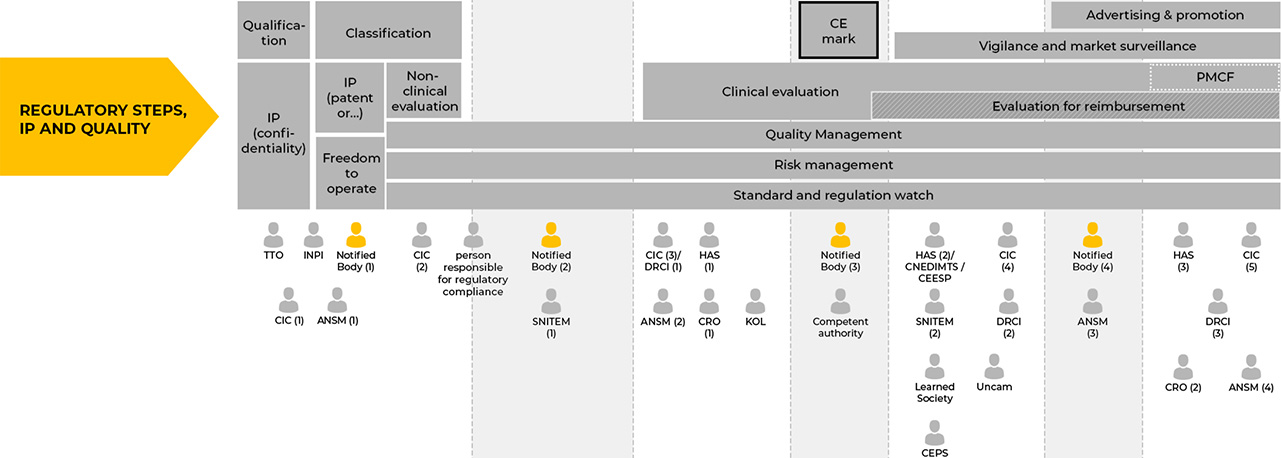
(1)
La classe du dispositif médical est déterminée en fonction de l’utilisation à laquelle le fabricant destine le produit. En cas de désaccord entre le fabricant et l’organisme notifié sur la qualification et la classification du produit, l’autorité compétente de l’Etat membre dans lequel le fabricant a son siège social peut être saisie.
/!\ Le règlement (UE) 2017/745change les classes de risque par rapport aux directives précédentes.
(2)
L’obtention du marquage CE passe par l’évaluation du système de gestion de la qualité du fabricant (règlement (UE) 2017/745, annexe IX)
Il est aussi important de contacter l’organisme notifié choisi en amont des évaluations cliniques en vue du marquage CE.
(3)
A l’exception de certains DM de classe I où cette responsabilité est reportée sur le fabricant, c’est à un organisme notifié choisi par le fabricant que revient la mission de conduire l’évaluation de la conformité aux exigences générales en matière de sécurité et de performances. Une fois la conformité démontrée, les fabricants peuvent établir la déclaration de conformité UE et apposer le marquage de conformité CE.
Attention, le fabricant ne peut faire appel qu’à un seul organisme notifié pour la même procédure d’évaluation de la conformité (article 20).
(4)
Le rôle de l’organisme notifié se poursuit une fois obtenu le marquage CE. Par exemple :
– l’organisme notifié peut effectuer des audits inopinés et soumettre les DM à des essais pour s’assurer que les fabricants continuent de respecter la réglementation.
– si le DM présente un risque grave, le fabricant doit prévenir l’organisme notifié ayant délivré le certificat de conformité et l’informer des éventuelles mesures correctives prises.
– les organismes notifiés s’assurent que le fabricant applique le système de gestion de la qualité approuvé et le plan de surveillance après commercialisation (PMCF).
Ressources Internet
Règlement (UE) 2017/745 du parlement européen et du Conseil, du 5 avril 2017, relatif aux dispositifs médicaux : https://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1516896388241&uri=CELEX:32017R0745
Parcours du dispositif médical en France, guide pratique de la HAS(novembre 2017, pdf) :https://www.has-sante.fr/portail/upload/docs/application/pdf/2009-12/guide_pratique_dm.pdf
« Nouvelle approche » (pour tous les marquages CE) : Guide relatif à la mise en application des directives élaborées sur la base des dispositions de la nouvelle approche et de l’approche globalehttps://www.eurogip.fr/fr/produits-information/documents-officiels-de-l-ue/289-guide-relatif-a-la-mise-en-application-des-directives-elaborees-sur-la-base-des-dispositions-de-la-nouvelle-approche-et-de-l-approche-globale
TEAM-NB, l’association européenne des organismes notifiés en dispositifs médicaux : http://www.team-nb.org/
LNE/G-MED : http://www.gmed.fr/pages/services/marquage_ce.asp

